Navigace:
Některé podmínky, bez nichž by neexistoval život
Vzduch
Plynný obal Země se nazývá ATMOSFÉRA.
Směsi látek potřebných k životu, tvořících spodní vrstvu atmosféry, říkáme VZDUCH.
Vzduch je tvořen těmito plyny:
dusíkem Nen, který tvoří asi 78% objemu vzduchu
kyslíkem Oó, který tvoří asi 21% objemu vzduchu.
Další plyny tvoří asi 1% objemu vzduchu, jsou to například vzácné plyny, různé oxidy.
Vzduch se zpracovává jako průmyslová surovina.
Využívá se kapalný vzduch získaný několikanásobným stlačováním, ochlazováním a rozpínáním plynu. Při každém rozepnutí stlačeného plynu se směs ochladí, tak postupně dojde k jejímu zkapalnění.
Ze zkapalněného vzduchu se jeho jednotlivé složky získávají destilací.
Kyslík a dusík se pro další využití přepravují v tlakových láhvích .
Kyslík
Nádoby s kyslíkem jsou označeny modrým pruhem.
Kyslík je nezbytný k dýchání, využívá se i ve zdravotnictví, při potápění v kyslíkových láhvích; dále v průmyslu, například při výrobě železa, ke sváření a řezání kovů.
Vzdušný kyslík způsobuje například erozi, zvětrávání. Dále tlení rostlin, kažení potravy a organického materiálu, ale působí i na materiály jako je železo a v součinnosti s dalšími vlivy, vlhkostí a solemi, působí korozi.
Kyslík podporuje hoření.
Naopak vyčerpá-li se kyslík, oheň uhasíná, což se využívá při hašení.
Hoření je chemický děj, při kterém vzniká teplo a světlo a látky se mění na jiné. Při hoření se spotřebovává kyslík a jako produkty hoření vznikají pevné látky (popel, saze) a plynné (CO2, H2O a jiné). Hoření je reakce kyslíku s hořlavou látkou.
Plamen označujeme jako sloupec hořících, většinou plynných, látek.
Pokus, kterým si lze přiblížit vznik kyslíku a to, že podporuje hoření, se provádí například reakcí peroxidu vodíku s oxidem manganičitým.
V kuželovité baňce o objemu 500 ml probíhá bouřlivá reakce oxidu manganičitého MnO2 a peroxidu vodíku H2O2. Unikající plyn je kyslík O2 (dvouatomová molekula kyslíku), což prokážeme, zasuneme-li do baňky rozžhavenou špejli, špejle vzplane, neboť kyslík podporuje hoření.
Obdobná reakce proběhne i s manganistanem draselným KMnO4.
Kyslík je nejrozšířenější prvek na Zemi.
V atmosféře je obsaženo asi 21% kyslíku.
Kyslík je obsažen i v zemské kůře v horninách, je i biogennímbijogenním prvkem, to znamená, že je obsažen v organických sloučeninách.
Kyslík je vysoce reaktivní plyn bez barvy, chuti a zápachu, vytváří sloučeniny téměř se všemi prvky, ve vzduchu se vyskytuje jako dvouatomová molekula O2, výjimečně jako ozón O3.
Kyslík se vyrábí destilací zkapalněného vzduchu.
Kyslík se využívá například při výrobě oceli a jiných kovů, zpracování ropy, ke spalování paliva v raketách, v kyslíkových hořácích, dále při úpravě vody, do dýchacích přístrojů.
Ozon
Ozon, tříatomová molekula kyslíku, O3 je plyn, který vzniká ze vzdušného kyslíku v přírodě za součinnosti slunečního záření a elektrického výboje, blesků.
Největší výskyt ozonu je ve výšce 25 až 35 km nad Zemí. Tato vrstva se nazývá ozonosféra.
Ozon zamezuje nebezpečnému kosmickému záření dopadat na zemský povrch.
Velkým problémem současnosti je porušování ozonové vrstvy například freony, což jsou hnací plyny do různých sprejů a látky tvořící náplň chladících zařízení. V současné době se snaží výrobci, i na základě přísných pravidel ochrany životního prostředí, od užívání freonů ustupovat.
Ozon O3, je takzvaný bakteriocidníbakterijocidní plyn, užívá se k ozonizaci pitné vody, pomocí které je voda zbavována choroboplodných zárodků, mikrobů. Ve vyšších koncentracích je však ozon zdraví škodlivý.
Ozon má silné oxidační účinky.
PbS + 2O3 ------> PbSO4 + O2
Reakce sulfidu olovnatého s ozonem za vzniku síranu olovnatého a dvouatomové molekuly kyslíku.
Dusík
Významnou složkou vzduchu je dusík N2.
78 %objemových procent je zastoupení dusíku v atmosféře. Vyskytuje se jako dvouatomová molekula.
Dusík je velmi málo reaktivní. Reaguje za vysokých teplot například s kyslíkem a tvoří oxidy, které jsou jedny z hlavních znečišťovatelů ovzduší.
V prostředí dusíku, by se člověk neotrávil, ale bez kyslíku nelze dýchat.
Dusík je nezbytný pro růst rostlin. Některé organismy jsou schopny, na rozdíl od lidského těla, vázat dusík ze vzduchu a využívat ho pro svoji stavbu.
V průmyslu se dusík využívá například k výrobě amoniaku NH3 a kyseliny dusičné HNO3 a mnoha dalších sloučenin.
Plynný dusík je nehořlavý, tato vlastnost se využívá k vytvoření ochranné atmosféry při skladování hořlavin, při sváření.
Faktory ovlivňující kvalitu ovzduší:
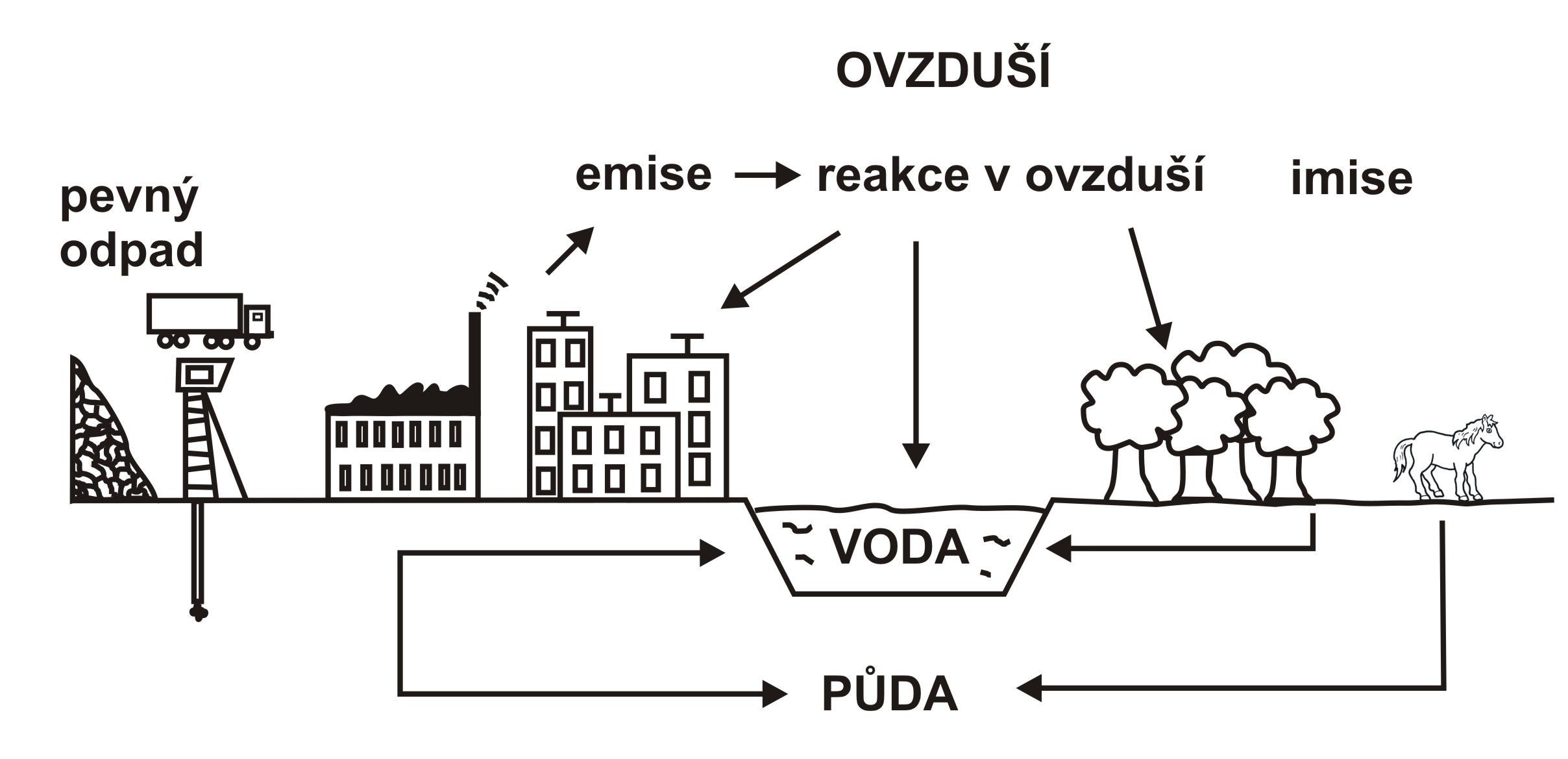
Za běžných podmínek tlak vzduchu se stoupající nadmořskou výškou klesá, stejně tak jako průměrná teplota.
V určitých ročních obdobích například v předjaří a na podzim může být situace opačná.
Spodní vrstva vzduchu se ochlazuje například od zemského povrchu, proto teplota směrem vzhůru může stoupat, především při bezvětří a dochází k teplotní inverzi, která zabraňuje promíchávání vzduchu.

Důsledkem toho, se v přízemních vrstvách drží zplodiny z průmyslových výrob, výfukové plyny. Často vzniká mlha a vytváří se smog, který má nepříznivý vliv na zdraví člověka.
Izobary jsou křivky na mapě, které spojují místa se stejným tlakem vzduchu na Zemi.
Voda
Voda je životodárná tekutina, je základní podmínkou života.
Hydrosféra je prostor, který voda zaujímá na Zemi – je to asi 71 %procent zemského povrchu.
Z veškeré vody je 97 %procent vody voda slaná. (Ve slané vodě je asi 3,5 %procenta rozpuštěných látek).
Sladké vody se vyskytují jen 3 %procenta, hlavní zásobárna sladké vody je v ledovcích.
Sladká i slaná voda obsahují minerály, rozdíl je v množství.
Koloběh vody v přírodě lze zjednodušeně popsat následujícími kroky:
– odpar z vodních ploch
ve vyšších vrstvách atmosféry vznikají mraky
– dochází ke kondenzaci a vzniká déšť
– mraky vyprší
část vody se odpaří, část se vsákne a část steče do potoků, řek, moří
a opět dochází k odparu.
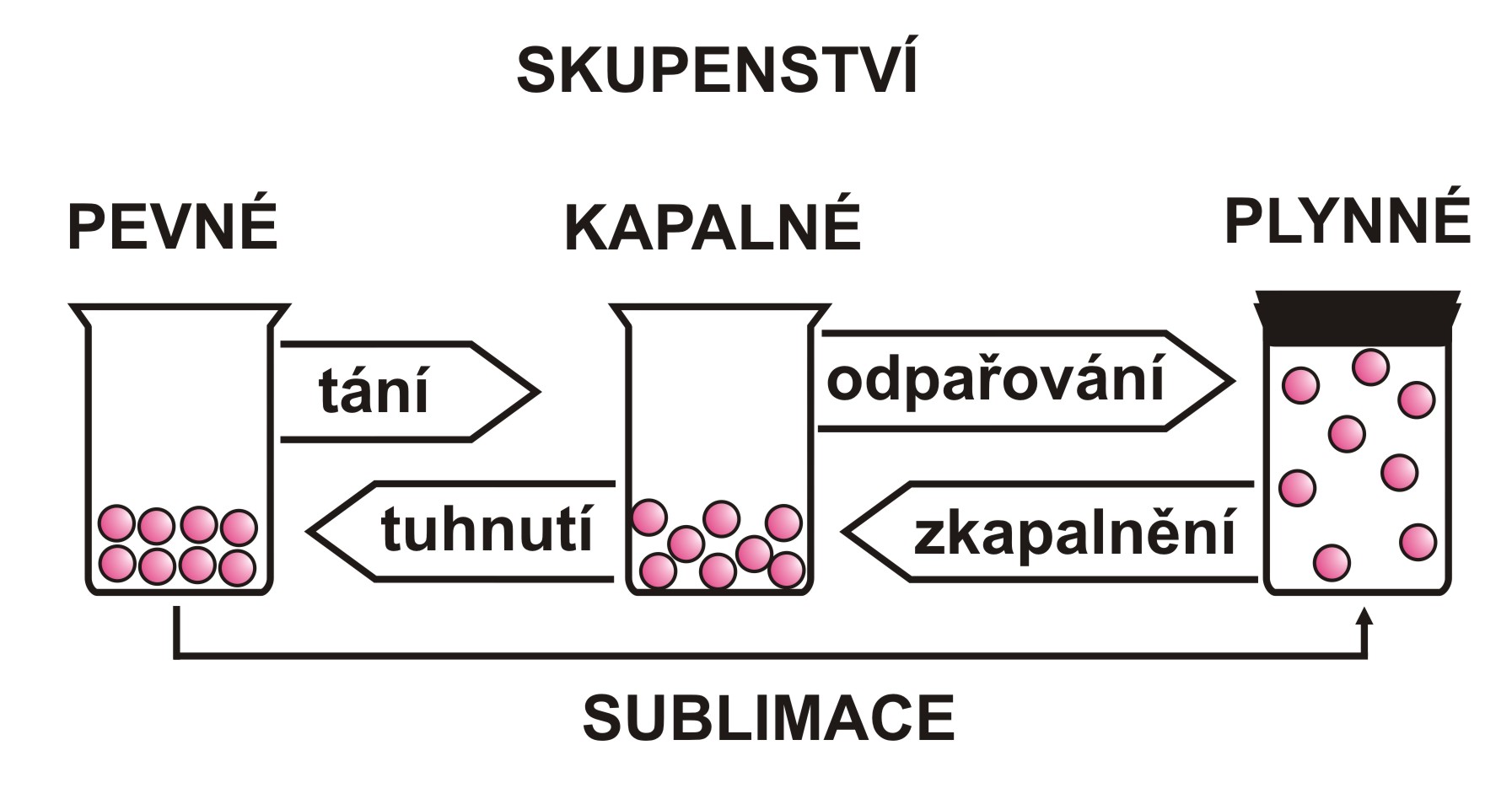
Skupenství vody.
Voda se v přírodě vyskytuje ve třech skupenstvích. V plynném jako pára, v kapalném jako voda a v pevném jako led.
Změna skupenství
Při změně skupenství z páry, z plynného skupenství, na vodu, kapalné skupenství, dochází ke kondenzaci.
Při změně z vody na páru se jedná o vypařování.
Změna z vody, kapalného skupenství, na led, tuhé skupenství, se nazývá tuhnutí.
Z ledu na vodu tání.
Z ledu, tuhého skupenství, na páru, plynné skupenství, se jedná o sublimaci.
Z páry na led desublimaci.
Druhy vody:
Podle obsahu minerálních látek (řazeno vzestupně):
- Destilovaná voda - bez obsahu minerálních látek, nelze využívat k pití
- Měkká voda - s nízkým obsahem minerálních látek
U tvrdé, minerální a slané vody obsah minerálních látek ve vodě stoupá.
- Tvrdá voda
- Minerální voda
- Slaná voda
V technologické praxi se rozlišují stupně tvrdosti vody.
Ve stupnici tvrdosti vody se většinou řadí tyto stupně:
(hodnoty obsahu minerálů jsou uváděny v milimolech na litr)
velmi měkká voda: 0 až 0,7
měkká voda: 0,7 až 1,3
středně tvrdá voda: 1,3 až 2,1
dosti tvrdá voda: 2,1 až 3,2
tvrdá voda: 3,2 až 5,3
velmi tvrdá voda: větší než 5,3
Dělení vody podle obsahu nečistot:
- Pitná – nezávadná, zdraví nepoškozující
- Užitková – nesmí se používat k pití, přípravě potravy a k mytí nádobí
- Odpadní – použitá voda z domácnosti, průmyslu; může znečišťovat vodní toky
Čištění odpadní vody probíhá několika způsoby
Samočištění vody = odstraňování nečistot z vody činností mikroorganismů.
Chemické čištění = působením chemických látek.
Biologické čištění = využíváním nezávadných mikroorganismů.
Úprava vody ve vodárnách
Do úpravny vody přichází znečištěná voda, většinou povrchová, ALE do vodovodního řadu je dodávána voda pitná, to znamená, že voda prochází složitým procesem úpravy, při kterém dochází k odstranění všech nečistot.
Postup úpravy vody
Nejprve přichází povrchová voda na síta
– je to soustava sít různé hrubosti, které filtrují vodu od mechanických nečistot.
Dále na čerpadla, ta načerpají vodu do usazovacích nádrží.
V usazovací nádrži probíhá chemické čištění.
Na chemickou látku se naváže nečistota a vytvoří povlak na hladině (popřípadě se usadí u dna – podle použité chemikálie).
Navázaná nečistota se odstraní.
Následuje pískový filtr. Voda přechází přes pískový filtr, který ji zbaví i jemných mechanických nečistot.
Ve finální fázi dochází k chlorování vody.
Voda je vedena k zásobníku chloru, kde dochází k zavedení chloru do vody. Chlor likviduje bakterie.
Může probíhat i ionizace, která má za cíl též zbavit vodu bakterií.
Čistá voda zbavená všech nečistot se odvádí do zásobníku čisté, pitné vody.
Ze zásobníku je voda pomocí čerpadel vedena ke spotřebiteli.
Voda z vodáren je velice pečlivě kontrolována. Je kontrolována často a důkladně.
Chloru se lze zbavit odstáním vody v nádobě. Chlor postupně vyprchá.
Z důvodu vyprchávání chloru z vody, může množství chloru kolísat podle vzdálenosti odběrného místa od vodárny.
Voda je součástí mnoha sloučenin.
Patří mezi nejrozšířenější rozpouštědla.
Zopakuj si:
- Jak lze jednoduše charakterizovat význam vody?
- Co to je hydrosféra?
- Popiš koloběh vody v přírodě.
- Jak lze rozdělit vodu podle obsahu minerálních látek?
- Jak dělíme vodu dle obsahu nečistot?
- Jakými základními způsoby probíhá čištění vody?
- Popiš základní kroky úpravy vody ve vodárnách.
.
Autor: Mgr. Jitka Krupařová
Použitá literatura: Doc. RNDr. Beneš Pavel, CSc., PhDr. Pumpr Václav, CSc., Doc. RNDr. Banýr Jiří, CSc. Základy chemie 1. díl pro 2. stupeň základní školy, nižší ročníky víceletých gymnázií a střední školy. Nakladatelství FORTUNA 2004. ISBN 80-7168-720-0 Doc. RNDr. Beneš Pavel, CSc., PhDr. Pumpr Václav, CSc., Doc. RNDr. Banýr Jiří, CSc. Základy chemie 2. díl pro 2. stupeň základní školy, nižší ročníky víceletých gymnázií a střední školy. Nakladatelství FORTUNA 2003. ISBN 80-7168-748-0 Mgr. Šibor Jiří, Ph.D., Mgr. Plucková Irena, Ph.D. , Mgr. Mach Josef. Chemie, Úvod do obecné a organické chemie, biochemie a dalších chemických oborů učebnice doporučujeme pro 9. ročník základní školy a odpovídající ročníky víceletého gymnázia. NOVÁ ŠKOLA, s.r.o. 2013. ISBN 978-80-7289-449-9 Mgr. Šibor Jiří, Ph.D., Mgr. Plucková Irena, Ph.D. , Mgr. Mach Josef. Chemie, Úvod do obecné a anorganické chemie učebnice doporučujeme pro 8. ročník základní školy a odpovídající ročníky víceletého gymnázia. NOVÁ ŠKOLA, s.r.o. 2010. ISBN 978-80-7289-133-7 Doc. RNDr. Čtrnáctová Hana, CSc., prof. Ing. Kolář Karel, CSc., PaedDr. Svobodová Miloslava, RNDr. Zemánek František. Přehled chemie pro základní školy. SPN – pedagogické nakladatelství, akciová společnost, 2006. ISBN 80-7235-260-1